
一种研究单个活细胞机械异质性的高通量DNA张力器平台。
Introduction
思路:
机械(力)调节可以使细胞避免对其发育有害的环境刺激,且单个细胞之间的异质性将导致不同的细胞行为和应激。
特定细胞亚型中机械力的异常调节可能将导致肿瘤发生或者产生耐药性等。
了解单细胞水平的力学特性是探索疾病发生和发展的重要指标,并进一步促进治疗策略的进步。
近年来对于细胞力学的分析方法有:
- 原子力显微镜(AFM)、光镊以及磁镊,通常是操控横梁或悬臂刺激细胞以获得机械响应,从而得到相关力学曲线,其分辨率可达pN级。其缺点是计算复杂,通量有限,不适用于基于大量细胞的临床分析;
- 牵引力显微镜(TFM)和微柱阵列检测器,采用随机分布有荧光粒子的基质变形状况来绘制大规模细胞的机械分布。这些方法显著提高了吞吐量,且方法简单和成本较低。其缺点是分辨率过低,仅为nN级,不足以识别单个细胞最细微的机械信息;
- 分子张力荧光显微镜(MTFM),将上述两种方法结合的一类方法,MTFM探针包含一对由“弹簧”分子结构(例如聚乙二醇、DNA、多肽和蛋白质)隔开的荧光供体/受体,细胞力可以根据弹簧的机械性质以及荧光供体/受体之间的距离进行量化,以达到pN级的分辨率。然而,这些方法仍然限于细胞通量,由于结合受体的随机位置,其量化细胞膜上力分布的能力较差。
作者开发了一个DNA张力器平台,该平台的优势在于:
- 高通量(数万个细胞)和pN级分辨率,能够绘制单个细胞上的机械力分布图;
- 实现细胞的实时和长期监测。
微孔底部是“发夹结构”的DNA张力器,可以固定在细胞膜上。一旦细胞机械力打开发夹,张力器上的荧光信号就会恢复,形成细胞力的指标。触发荧光的阈值力可以通过计算和合成DNA张力器的纳米长度来定制,以达到pN级分辨率。
Design of a DNA Tensioner Platform
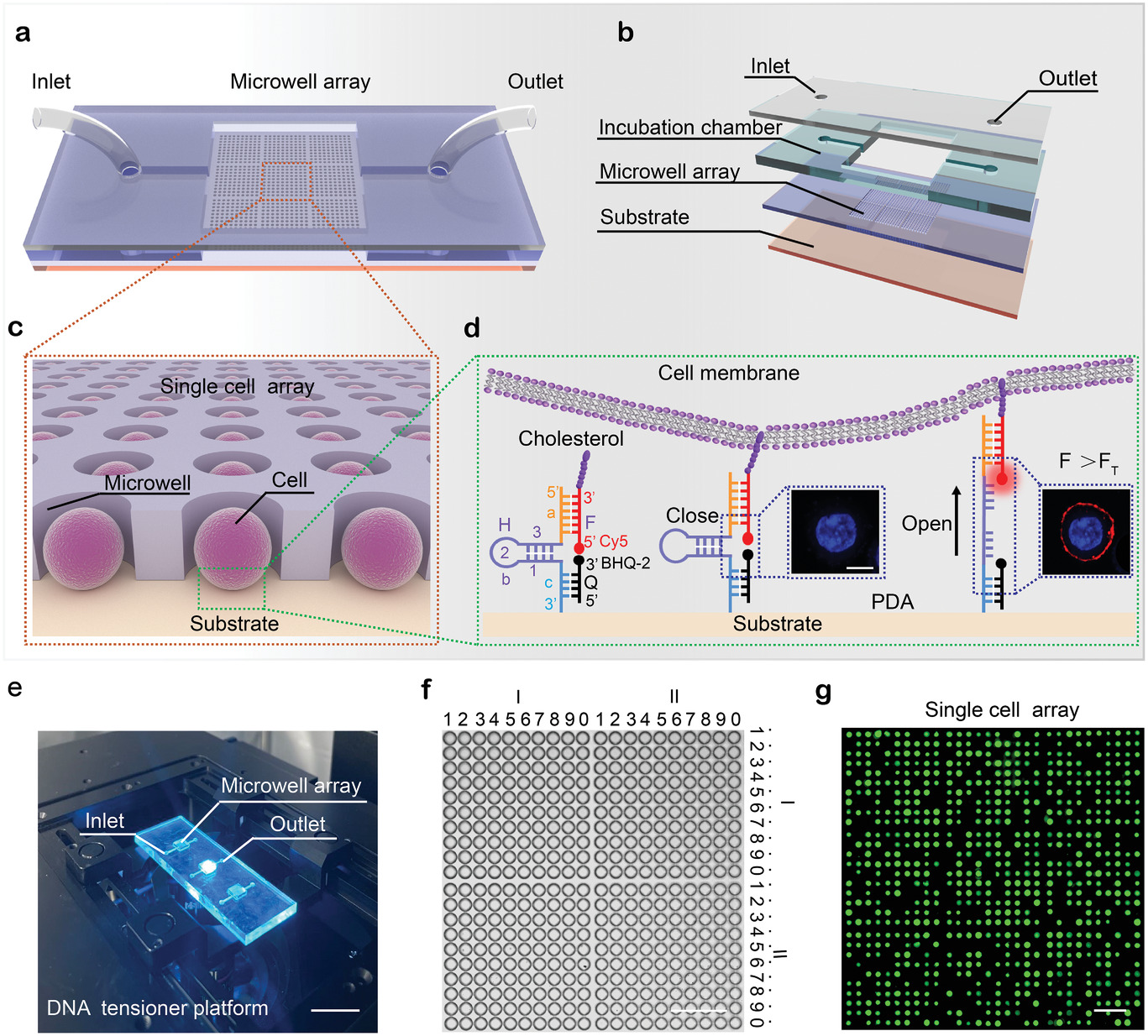
- (a)用于检测单细胞机械力的高通量DNA张力器平台示意图。
- (b)微孔阵列芯片的分层组装。
- (c)单细胞阵列的示意图。
- (d)DNA张力器的结构示意和工作原理。该张力器由三个DNA序列F、Q和H杂交组装而成。序列H的3’端修饰氨基以锚定在微孔底部。序列H的一部分,即Ha,与胆固醇标记的序列F杂交,另一部分序列Hc与猝灭剂标记的序列Q杂交。H的剩余中间序列,即Hb,由序列H-b1和H-b3互补组装成“发夹”结构,使得序列F的5’端靠近序列Q的3’端。因此,根据荧光共振能量转移原理,荧光团Cy5(标记在序列F,红色)的5’端被淬灭剂淬灭(标记在序列Q的3’端)。当单细胞被捕获并沉降在微孔的底部,由于张力器中F序列修饰胆固醇,胆固醇可以插入细胞膜上的疏水区域,因此DNA张力器可以随着细胞机械力的动态变化而被拖动。一旦细胞机械力超过H-b1和H-b3对DNA张力器“发夹”结构的结合力,DNA张力器的发夹结构就会打开,导致荧光团与猝灭剂的距离增加,荧光团从而恢复荧光。当机械力低于结合力时,序列H-b1和H-b3将恢复结合状态,荧光团再次被封闭猝灭剂猝灭。得益于“淬灭”和“荧光发射”之间的可逆性,DNA张力器能够动态检测单个细胞的机械力。
- (e)DNA张力器平台的照片。
- (f)用于图案化单细胞的可寻址微孔阵列的布局。
- (g)图案化的单细胞阵列。
Design Theory and Validation of the DNA Tensioner
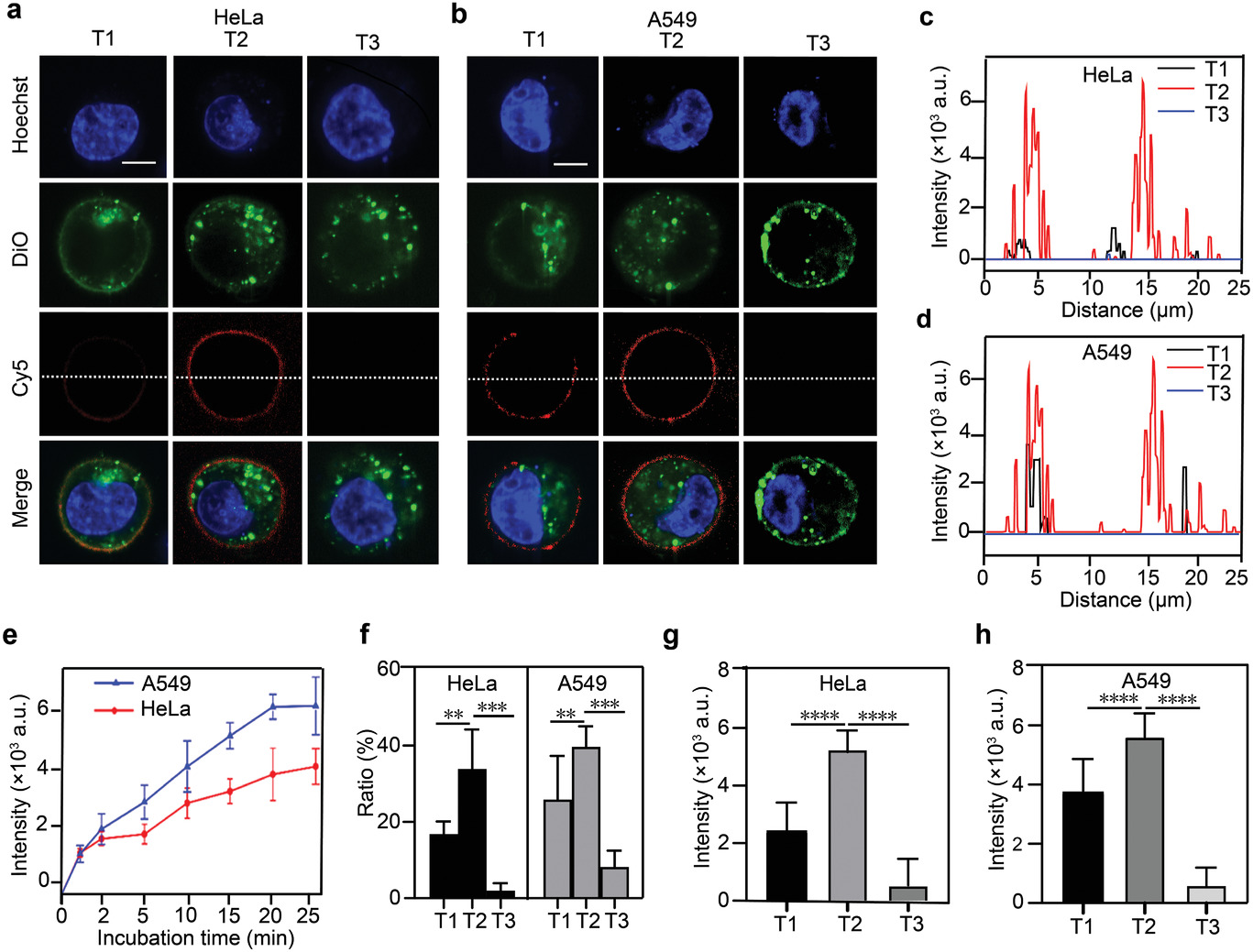
在许多生物事件(如T细胞的免疫反应激活、离子通道的开放和整合素-ECM键的破裂)中,单个细胞传递典型的pN级力。作者通过计算,在所设计DNA张力器中拉直发夹结构所需的力为≈11 pN,这在理论上表明,DNA张力器对细胞机械力的量化低至pN水平。
- (a-b)由DNA张力器平台检测的HeLa和A549细胞的代表性荧光图像。作者设计了三种类型的DNA张力器,即T1、T2和T3,分别具有不同的互补序列长度H-b1和H-b3(T1<T2<T3)。为了证明DNA张力器平台可以实时检测细胞张力,作者将细胞培养到三种类型DNA张力器修饰的聚多巴胺(PDA)微孔阵列上。结果表明,接种在T2标记底物上的细胞在几分钟内就开始显示荧光,其灵敏度显著高于T1和T3。
- (c-d)HeLa细胞和A549细胞的白线区域的荧光强度分布。由于DNA张力器只有在细胞机械力大于DNA链的结合力时才会发出荧光,所以DNA张力器的荧光分布显示的是超过阈值的细胞机械力的分布,而不是整个细胞膜的底部。
- (e)HeLa和A549细胞的机械力诱导的DNA张力器的荧光反应。
- (f)有机械反应的HeLa和A549细胞占肿瘤细胞总数的比例。
- (g-h)HeLa和A549细胞的DNA张力器反应的荧光强度。根据三种DNA张力剂的荧光响应,T2的荧光强度最高,被认为是探测细胞力的最佳选择。
Single-Cell Mechanical Force Analysis of Drug-Resistant Tumor Cells
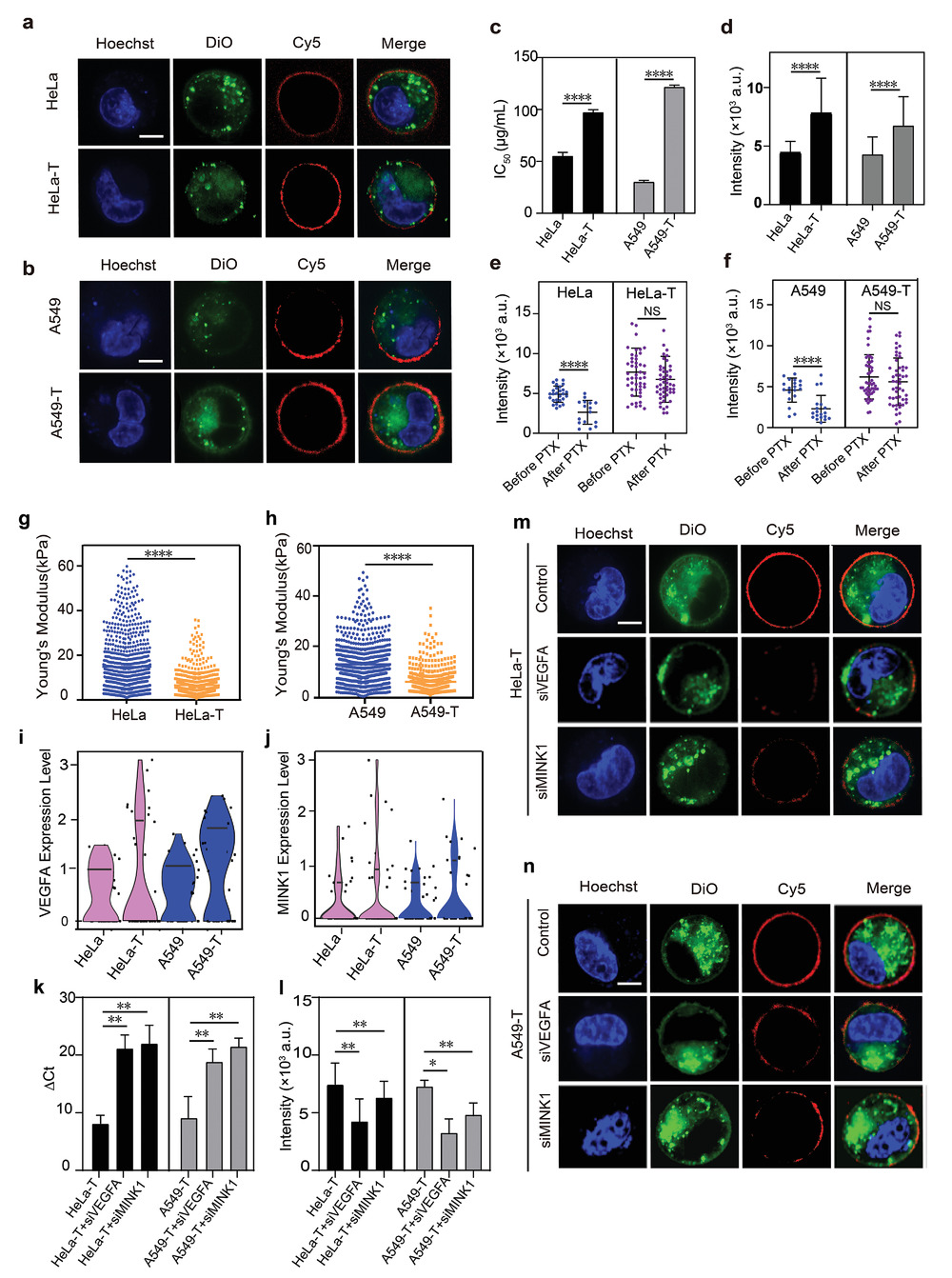
目前,耐药性被认为是癌症治疗失败的主要原因,某些类型的药物如紫杉醇(PTX),通过破坏细胞骨架的形成来杀死肿瘤细胞,而细胞骨架对于细胞产生机械力和对ECM的反应是至关重要的。作者推测耐药性的特征可能在肿瘤发展过程中伴随着细胞力学性质的变化。为了验证这一假设,作者以两种类型的PTX抗性细胞(HeLa-T和A549-T)为模型,在该平台上测试了它们的机械性能。
- (a-b)由DNA张力器平台检测的PTX敏感细胞(HeLa和A549)和PTX抗性细胞(HeLa-T和A549-T)的代表性荧光图像。
- (c)PTX药物的半抑制浓度(IC50)。
- (d)DNA张力器的荧光信号来自PTX敏感和PTX抗性细胞。大多数PTX抗性细胞的荧光强度明显高于PTX敏感性细胞。
- (e-f)细胞的机械力随PTX的孵化而变化。PTX抗性细胞在与含有PTX的培养基一起孵育时表现出稳定的荧光分布,表明 PTX 抗性细胞的机械性能不受PTX药物的影响。
- (g-h)用AFM检测(g)HeLa/HeLa-T以及(h)A549/A549-T的杨氏模量。结果表明,PTX抗性细胞(HeLa-T和A549-T)比PTX敏感细胞(HeLa和A549)更柔软。
- (i-j)RNA测序VEGFA和MINK1在(i)HeLa/HeLa-T(j)A549/A549-T中的表达水平。耐药细胞的VEGFA和MINK1基因的表达上调,这两个基因与细胞迁移和细胞骨架重塑相关。
- (k)HeLa-T和A549-T在用siVEGFA和siMINK1处理前后的qPCR结果。ΔCt为甘油三磷酸酯脱氢酶(GAPDH)RNA的Ct值与目标RNA的Ct值之差,图示表明目标基因表达水平下调。
- (l)用siVEGFA和siMINK1处理前后HeLa-T和A549-T的荧光强度。
- (m-n)用siVEGFA和siMINM1处理前后,(m)HeLa-T和(n)A549-T细胞的代表图像。DNA张力器平台检测到细胞机械荧光信号显著降低,表明细胞的机械力受到基因下调的抑制。以上结果表明VEGFA和MINK1与耐药细胞的机械力增加机制正相关,这些基因可能参与了耐药性出现过程中的机械调节。
siRNA,短干扰RNA,用于下调基因表达。
Single-Cell Mechanical Force Interrogation of Tumor Metastasis
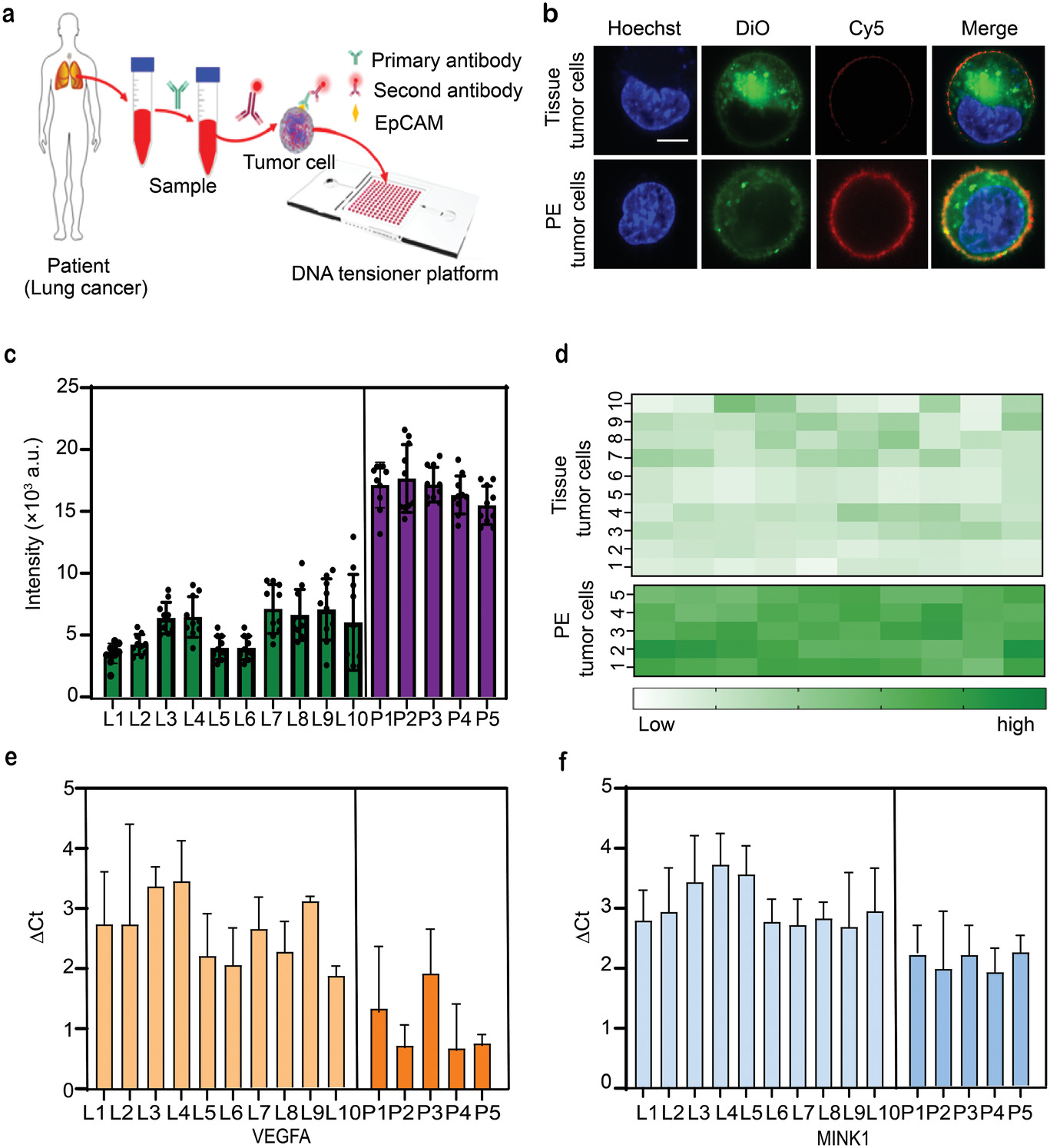
- (a)用DNA张力器平台检测临床肿瘤细胞的流程。为了评估平台获取原发性肿瘤细胞和转移性肿瘤细胞之间机械差异的能力,作者收集了10个(L1-L10)肺癌组织的原发肿瘤细胞样本和5个(P1-P5)肺癌胸腔积液中肿瘤细胞样本。作者基于癌细胞生物标志物上皮细胞粘附分子(EpCAM)的免疫荧光染色来鉴定肿瘤细胞,然后将分选的EpCAM阳性原发性肿瘤细胞放置在DNA张力器平台上进行机械测量。
- (b)在DNA张力器平台上检测的组织肿瘤细胞和胸腔积液(PE)肿瘤细胞的荧光图像。可见荧光强度存在明显差异,表明原发性肺癌细胞之间存在显著的机械力异质性。
- (c)荧光强度定量。
- (d)荧光信号热图。由此可见肺癌组织原代细胞的机械力明显低于胸腔积液原代肿瘤细胞的机械力,表明转移性肿瘤细胞具有比非转移性肿瘤细胞更高的机械力。
- (e-f)原代肿瘤细胞样本中VEGFA和MINK1的qPCR结果。与非转移性肿瘤细胞相比,转移性肺癌细胞显示出VEGFA和MINK1的表达增加,说明这两个基因可能在肿瘤转移中起重要作用。以上结果表明,该平台根据机械异质性可以区分非转移性肿瘤细胞和转移性肿瘤细胞。
Discussion
目前测量细胞力学的工具在难以同时实现高通量和高力分辨率(pN级),该平台提供了一个解决方案。
胆固醇是细胞膜上的普遍元素,可以感知大多数细胞的力分布,因此DNA张力器被设计成与胆固醇相连。
通过使用该平台,作者发现:
- 耐药细胞与非耐药细胞相比增强的机械力;
- 胸腔积液中转移性肿瘤细胞和非转移性组织细胞之间的机械力差异;
- VEGFA和MNK1可能在调节机械异质性中起决定性作用。
Reference
Hang X, He S, Dong Z, et al. High-Throughput DNA Tensioner Platform for Interrogating Mechanical Heterogeneity of Single Living Cells[J]. Small, 2022, 18(12): 2106196.



